经皮冠状动脉介入治疗
经皮冠状动脉介入治疗( percutaneous coronary intervention,PCI),是指经心导管技术疏通狭窄甚至闭塞的冠状动脉管腔,从而改善心肌的血流灌注的治疗方法。
发展历程
1844年,Bernard首次将导管插入动物的心脏。
1929年,德国医生Forssmann首次将一根尿管从自己的肘静脉插入,
经上腔静脉送入右心房,并拍摄下了医学史上第一张心导管胸片,开创了人类心导管技术发展的先河。在此基础上,
先后开展了右心导管和左心导管术。1953年,Seldinger创立了经皮血管穿刺技术,从而结束了介入操作需要进行血管切开的历史。
1958年,Sones在进行一次主动脉造影时,无意中将导管插入右冠状动脉,并注入了造影剂使右冠显影。
这一偶然并带有危险性的事件却成为了现代冠脉介入技术的开端。1967年Judkins采用股动脉穿刺的方法进行了冠状动脉造影,
从此这一技术在冠心病的诊断上得以进一步的发展和推广。德国的Gruentzig于1977年首先施行了经皮冠状动脉成形术。
此后,PTCA技术从欧洲到美洲迅速被推广,适应症不断扩大。与之相关的工业产品也迅速发展,各种操作设备(如:导管、球囊)不断改进以适应不同病变的处理。
1986年,Puol和Sigmart将第一枚冠脉支架置入人体。冠脉内支架置入术可显著减少PTCA的再狭窄,可以处理夹层和急性血管闭塞,
成为冠脉介入治疗的又一个里程碑。
2003年药物洗脱支架(drug-eluting stent,DES)投入临床,使支架的再狭窄率明显降低,使冠脉介入治疗又进入到一个新的纪元。
上世纪90年代,Christian Herdeg及其同事在动物模型中进行了“双球囊”和“微孔球囊”系统紫杉醇局部给药的探索,证实了脂溶性药物能较快被组织吸收。
Ulrich Speck及Bruno Scheller的研究显示,在冠脉中注入造影剂能改善紫杉醇复合物在血管壁上的吸收,
能有效抑制模型动物发生再狭窄。这一结果带来了一种新的药物输送球囊系统的出现——药物球囊。
技术分类
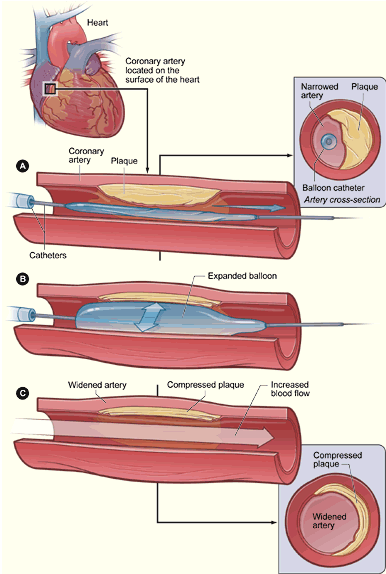
1.经皮冠状动脉球囊血管成形术(percutaneous coronary angioplasty,PTCA)
采用股动脉途径或桡动脉途径,将指引导管送至待扩张的冠状动脉口,再将相应大小的球囊沿导引钢丝送到狭窄的节段,
根据病变的特点用适当的压力和时间进行扩张,达到解除狭窄的目的。但单纯PTCA的冠状动脉急性闭塞和再狭窄的发生率较高。
急性闭塞多见于术后24小时内,发生率在3%-5%,可导致患者急性心肌梗死,甚至死亡。
再狭窄一般发生于术后6个月内,发生率在25%-50%,患者会再次出现心绞痛症状,大多需要再次血运重建。由于以上的局限性,目前已很少单独使用。
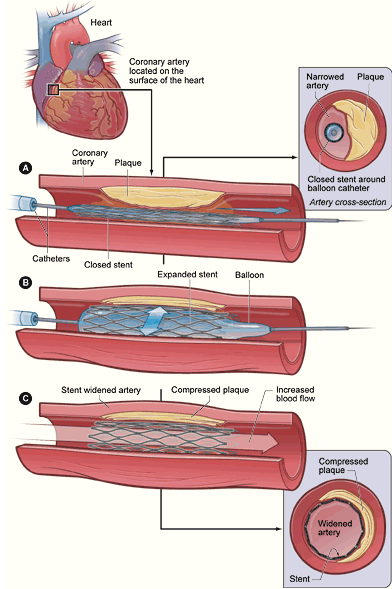
2.冠状动脉支架植入术
将以不锈钢或合金材料制成的网状带有间隙的支架置入冠状动脉内狭窄的部位,以便支撑血管壁,维持血流通常,
可减少PTCA后的血管弹性回缩,并封闭PTCA时可能产生的夹层,大大减少了PTCA术中急性血管闭塞的发生。
但由于支架置入部位内膜增生性改变,术后支架内再狭窄仍是主要的问题。早期应用的是裸金属支架(bare metal stent,BMS),
术后6个月内再狭窄率为20%-30%。药物洗脱支架(drug-eluting stent,DES)在裸支架的金属表面增加了具有较好生物相容性的涂层和药物,
此种支架置入后,平滑肌的增生被抑制,使再狭窄进一步降低至10%以下。但DES使血管内皮化延迟而造成支架内血栓发生率较高。
3.药物涂层球囊扩张术
药物涂层球囊(drug coated balloon,DCB)作为经皮冠状动脉介入治疗技术中的后起之秀,可运送抗增殖药物(如:紫杉醇)
到达病变部位以抑制血管内膜增生,并且不增加金属支架层,降低血管炎症反应及支架内血栓形成风险,
实现“介入无植入”的理想化治疗效果。目前,药物涂层球囊在原位病变(如:小血管病变、分叉病变)、支架内再狭窄等领域已经显示出良好的治疗效果。
介入路径
1.股动脉路径
股动脉比较粗大,穿刺成功率高。缺点是术后卧床时间长,穿刺相关并发症发生率较高,
如:出血、血肿、假性动脉瘤、动静脉瘘和腹膜后血肿等。
2.桡动脉路径
术后压迫时间短,无需卧床,患者不适感较股动脉路径轻,而且并发症较少,因此逐渐成为目前PCI治疗的首选路径。
发展历程
1844年,Bernard首次将导管插入动物的心脏。
1929年,德国医生Forssmann首次将一根尿管从自己的肘静脉插入,
经上腔静脉送入右心房,并拍摄下了医学史上第一张心导管胸片,开创了人类心导管技术发展的先河。在此基础上,
先后开展了右心导管和左心导管术。1953年,Seldinger创立了经皮血管穿刺技术,从而结束了介入操作需要进行血管切开的历史。
1958年,Sones在进行一次主动脉造影时,无意中将导管插入右冠状动脉,并注入了造影剂使右冠显影。
这一偶然并带有危险性的事件却成为了现代冠脉介入技术的开端。1967年Judkins采用股动脉穿刺的方法进行了冠状动脉造影,
从此这一技术在冠心病的诊断上得以进一步的发展和推广。德国的Gruentzig于1977年首先施行了经皮冠状动脉成形术。
此后,PTCA技术从欧洲到美洲迅速被推广,适应症不断扩大。与之相关的工业产品也迅速发展,各种操作设备(如:导管、球囊)不断改进以适应不同病变的处理。
1986年,Puol和Sigmart将第一枚冠脉支架置入人体。冠脉内支架置入术可显著减少PTCA的再狭窄,可以处理夹层和急性血管闭塞,
成为冠脉介入治疗的又一个里程碑。
2003年药物洗脱支架(drug-eluting stent,DES)投入临床,使支架的再狭窄率明显降低,使冠脉介入治疗又进入到一个新的纪元。
上世纪90年代,Christian Herdeg及其同事在动物模型中进行了“双球囊”和“微孔球囊”系统紫杉醇局部给药的探索,证实了脂溶性药物能较快被组织吸收。
Ulrich Speck及Bruno Scheller的研究显示,在冠脉中注入造影剂能改善紫杉醇复合物在血管壁上的吸收,
能有效抑制模型动物发生再狭窄。这一结果带来了一种新的药物输送球囊系统的出现——药物球囊。
技术分类
1.经皮冠状动脉球囊血管成形术(percutaneous coronary angioplasty,PTCA)
采用股动脉途径或桡动脉途径,将指引导管送至待扩张的冠状动脉口,再将相应大小的球囊沿导引钢丝送到狭窄的节段,
根据病变的特点用适当的压力和时间进行扩张,达到解除狭窄的目的。但单纯PTCA的冠状动脉急性闭塞和再狭窄的发生率较高。
急性闭塞多见于术后24小时内,发生率在3%-5%,可导致患者急性心肌梗死,甚至死亡。
再狭窄一般发生于术后6个月内,发生率在25%-50%,患者会再次出现心绞痛症状,大多需要再次血运重建。由于以上的局限性,目前已很少单独使用。

2.冠状动脉支架植入术
将以不锈钢或合金材料制成的网状带有间隙的支架置入冠状动脉内狭窄的部位,以便支撑血管壁,维持血流通常,
可减少PTCA后的血管弹性回缩,并封闭PTCA时可能产生的夹层,大大减少了PTCA术中急性血管闭塞的发生。
但由于支架置入部位内膜增生性改变,术后支架内再狭窄仍是主要的问题。早期应用的是裸金属支架(bare metal stent,BMS),
术后6个月内再狭窄率为20%-30%。药物洗脱支架(drug-eluting stent,DES)在裸支架的金属表面增加了具有较好生物相容性的涂层和药物,
此种支架置入后,平滑肌的增生被抑制,使再狭窄进一步降低至10%以下。但DES使血管内皮化延迟而造成支架内血栓发生率较高。

3.药物涂层球囊扩张术
药物涂层球囊(drug coated balloon,DCB)作为经皮冠状动脉介入治疗技术中的后起之秀,可运送抗增殖药物(如:紫杉醇)
到达病变部位以抑制血管内膜增生,并且不增加金属支架层,降低血管炎症反应及支架内血栓形成风险,
实现“介入无植入”的理想化治疗效果。目前,药物涂层球囊在原位病变(如:小血管病变、分叉病变)、支架内再狭窄等领域已经显示出良好的治疗效果。
介入路径
1.股动脉路径
股动脉比较粗大,穿刺成功率高。缺点是术后卧床时间长,穿刺相关并发症发生率较高,
如:出血、血肿、假性动脉瘤、动静脉瘘和腹膜后血肿等。
2.桡动脉路径
术后压迫时间短,无需卧床,患者不适感较股动脉路径轻,而且并发症较少,因此逐渐成为目前PCI治疗的首选路径。
